2.1.2 Chemischer AspektAbb.1: Strukturformel von Formaldehyd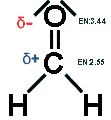 Formaldehyd ist das einfachste aller Aldehyde. Es besitzt die für Aldehyde spezifische endständige Carbonylgruppe, woraus auch das hohe Reaktionspotenzial resultiert (Strukturformel siehe Abb.1). Die Polarität der C=O-Zweifachbindung ist dabei die Besonderheit. Die Elektronen verschieben sich in Richtung des elektronegativeren Sauerstoffatoms, so dass sich auf der Seite des Sauerstoffatoms eine negative und auf der Seite des Kohlenstoffatoms eine positive Partialladung ergibt. Dadurch, dass in dem Molekül keine Alkyl-Reste sind, kommt es nicht durch ihren +I-Effekt zu einer Herabsetzung der Partialladung. Darum ist Formaldehyd das reaktivste aller Aldehyde.
Formaldehyd ist das einfachste aller Aldehyde. Es besitzt die für Aldehyde spezifische endständige Carbonylgruppe, woraus auch das hohe Reaktionspotenzial resultiert (Strukturformel siehe Abb.1). Die Polarität der C=O-Zweifachbindung ist dabei die Besonderheit. Die Elektronen verschieben sich in Richtung des elektronegativeren Sauerstoffatoms, so dass sich auf der Seite des Sauerstoffatoms eine negative und auf der Seite des Kohlenstoffatoms eine positive Partialladung ergibt. Dadurch, dass in dem Molekül keine Alkyl-Reste sind, kommt es nicht durch ihren +I-Effekt zu einer Herabsetzung der Partialladung. Darum ist Formaldehyd das reaktivste aller Aldehyde.Allgemein neigen Aldehyde als ungesättigte Verbindungen zu Additionsreaktionen, wobei als Reaktionspartner z.B. Alkohole, Ammoniak, Wasser und generell Anionen dienen. Charakteristisch für Additionsreaktionen ist hier die nucleophile Addition in Gegenwart von Hydronium-Ionen. Daher kommt auch die Fähigkeit zur Polymerisation bzw. Selbstaddition (Polymerisation graphisch siehe Anhang 7.1.1). Unter Einfluss von Katalysatoren durch Anlagerung von Wasserstoff kann auch der Alkohol Methanol entstehen. Durch die freien Elektronenpaare des Sauerstoffatoms ergibt sich die hohe Wasserlöslichkeit des Formaldehyds. Sie sind in der Lage mit Wassermolekülen Wasserstoffbrückenbindungen zu ermöglichen (ASSELBORN et al.2000, HÄUSLER 1981, Stoffeigenschaften des Formaldehyds siehe Anhang 7.1.2). |