5.2 VersucheObwohl bereits ca. 15% mehr Formaldehyd-Lösung eingesetzt wurde, konnte in keiner der Leerflaschen die gewünschte Konzentration erreicht werden. Im 2. Versuch wurde eine Probe ohne Wolle und ohne Formaldehyd angesetzt. Dabei zeigte sich, dass sich in der Flaschen-Luft selbst ca. 12,8µg (4,4ppm) Formaldehyd nachweisen lassen. Eine reichlich hohe Konzentration, verglichen mit dem MAK-Wert von 0,78ppm. Da aber in der Probe ohne FA mit Wolle noch eine deutlich erkennbare Reduktion des FA-Gehaltes zu erkennen ist, kann der hohe Formaldehyd-Gehalt nur durch FA in Apparatur und Abzug erklärt werden. Auf jeden Fall ist eine eindeutige Konzentration nachgewiesen worden, die man eigentlich als Fehler mit in die Messungen einbeziehen müßte. Da dieser Fehler aber bei allen Versuchen annähernd gleich sein müßte, kann man diesen Fehler bei der Betrachtung der eigentlichen Ergebnisse vernachlässigen.Die starken Abweichungen der erreichten Gaskonzentrationen lassen sich nicht auf Messungenauigkeiten beim Verdünnen zurückführen, denn eine zur Kontrolle zeitgleich mit Versuch 3 angesetzte Eichkurve aus der selben Formaldehydlösung ergab keine Abweichung von der zu Beginn erstellten Eichkurve. Damit wurde bestätigt, dass Lösungen und Messverfahren vergleichbar waren. Es muss also zu deutlich reduziertem Übertritt des eingesetzten FA in die Gasphase oder zu Verlusten während der Standzeit gekommen sein. Die Schott-Flaschen könnten nicht richtig dicht gewesen sein oder das Gummi der Stopfen könnte FA absorbiert haben. Allerdings scheinen die festgestellten Abweichungen eher durch die vorgegebene FA-Menge beeinflusst worden zu sein, denn bei höherer Konzentration ist eher eine Abflachung der Kurve zu erkennen (siehe Abb.6). Der Langzeitversuch zeigt jedoch, dass es auch zu Undichtigkeiten oder einer Absorption durch den Stopfen gekommen sein kann (siehe Abb.6). Während der Messung könnte nicht alles Formaldehyd der Schott-Flaschen erfasst worden sein. Die niedrigen Werte der zweiten Waschflaschen lassen aber vermuten, dass nur sehr geringe Anteile nicht in der MBTH-Lösung aufgefangen wurden. Wohl eher haben 10 Minuten doch nicht ausgereicht, um das gesamte Formaldehyd-Gas, aus den Schott-Flaschen heraus zu pumpen. Weiterhin wäre denkbar, dass das Formaldehyd nicht vollständig aus der Lösung verdampft wäre. Da sich aber im 1. Versuch wenigsten schon Werte ergeben hatten, die halb so hoch waren, wie die Konzentration, welche eigentlich angestrebt wurde, muss es für die niedrigen Konzentrationen bei dem 2. und 3. Versuch noch andere Gründe geben. Es besteht die Möglichkeit, dass das Formaldehyd aufgrund seines hohen Reaktionspotenzials anderweitig Reaktionspartner gefunden hat. Nur die Gefäße des 2. und 3.Versuchs wurden zusätzlich noch erhitzt, wodurch eigentlich der Übergang in die Gasphase begünstigt werden sollte, und somit auch eine höhere Konzentration in den Flaschen erwartet wurde. Da jedoch eher das Gegenteil der Fall war, könnten statt dessen andere Reaktionen begünstigt worden sein. Charakteristisch sind für Aldehyde als ungesättigte Verbindungen Additionsreaktionen unter anderem mit Alkoholen wie z.B. Methanol. Es ist denkbar, dass das Methanol das Formaldehyd nicht nur stabilisiert, sondern sogar damit reagiert hat. Da jede Versuchreihe in sich gleich behandelt wurde, bleiben Leer- und Proben mit Wolle durchaus vergleichbar, wenn man ausschließt, dass einzelne Behältnisse undicht waren und es beim Messen zu einem der angesprochenen Fehler gekommen ist. Im Allgemeinen war immer ein Abbau des Formaldehyds nachzuweisen. Die Wolle muss das zugegebene Formaldehyd also in irgendeiner Weise absorbiert haben. Die Abbauraten schwanken von 79,6% bis 95,6%. Die Forschergruppe des Deutschen Wollinstitutes Aachen hat belegt, 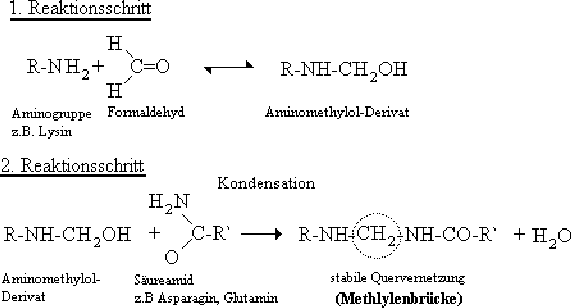 Abb.7: Reaktion von Formaldehyd mit einer Aminogruppe des Wollproteins dass Formaldehyd über die Wolloberfläche ins Faserinnere diffundiert. Die eindiffundierten Moleküle können mit vielen Aminosäure-Seitenketten chemisch reagieren, insbesondere mit den Seitengruppen der Aminosäuren Lysin, Glutamin, Asparagin, Histidin, Arginin, Tyrosin, Tryptophan, Cystin und Cystein (WORTMANN et al. 1999, vergleiche Abb.7). Ich komme durch meinen Versuch also auch zu dem Schluss, dass Wolle in der Lage ist den gefährlichen Raumluftschadstoff Formaldehyd aus der Luft zu absorbieren. Durch die Bestätigung des Deutschen Wollforschungsinstituts und der Technischen Hochschule in Aachen kann heute das patentierte Wollvlies Namens Kairatin von der Herstellerfirma Doppelmayer in Kempten durch die Raab Karcher vertrieben werden. Die Absorbtionsfähigkeit der Wolle wird noch verbessert, indem man die Wollfette auswäscht und dann daraus ein Vlies mit möglichst großer Oberfläche herstellt. Dieses Errungenschaft der Wissenschaft ist eine umweltfreundliche und vergleichsweise billige Möglichkeit, um den Luftschadstoff Formaldehyd wirksam aus Gebäuden zu entfernen. Gerd Zwiener vom Eco-Umweltinstitut in Köln erklärt: "Die Versuche lassen den Schluss zu, dass die Aufnahmekapazität der Wolle für mindestens zehn Jahre reicht." (PURTUL 2001). Wolle soll nicht nur Formaldehyd binden, sondern ebenso Schadstoffe wie Stickoxide, Ozon und Amine. Diese sind weitere Ziele, die man erreichen möchte. Auch die Autoindustrie hat hier schon Interesse angemeldet. So sollen durch Wolle die Gerüche in Neuwagen entfernt werden (PURTUL 2001). Als nachwachsender Rohstoff wird Wolle heute auch immer gefragter in Bereichen der Gebäudedämmung. Sie ist im Gegensatz zu synthetischen Fasern sehr anpassungsfähig, denn in der Natur, nämlich beim Schaf selbst wirkt sie wie eine Art Klimaanlage. Der Fakt, dass Wolle auch ein Schadstofffänger ist, macht diesen Rohstoff noch attraktiver. |